日本では毎年およそ40~50種類の新しいくすり(新医薬品)が開発されています。
新薬の開発は候補物質の探索(基礎研究)にはじまり、さまざまな研究や試験を行います。
医薬品・再生医療等製品等の開発の全体像
上市前(創薬)
基礎研究
(2~3年)
くすりのモトとなる新規物質の発見と創製
非臨床試験
(3~5年)
新規物質の有効性と安全性の研究
臨床試験
(3~7年)
ヒトを対象とした有効性と安全性の試験(治験)
承認申請審査
(1~2年)
厚生労働省への承認申請と専門家による審査
上市後(育薬)
製造販売後調査
発売後の安全性や使用法のチェック
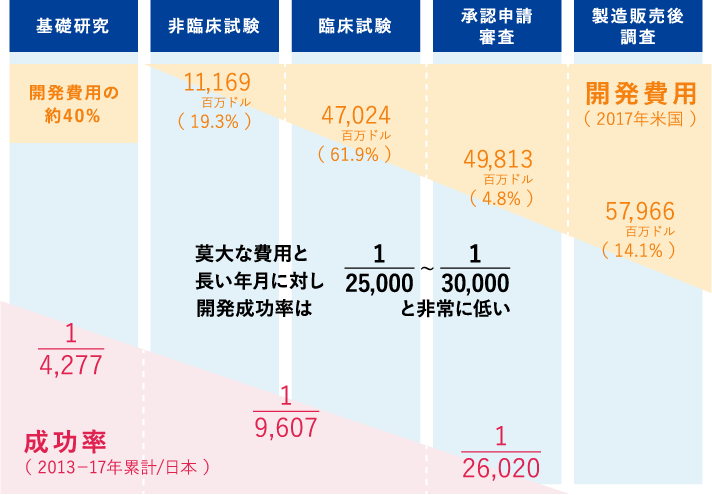
『開発費用』引用元:日本製薬工業協会 DATA BOOK 2019 A7-8 製薬企業の研究開発費の段階別構成比(米国)
『成功率』引用元:日本製薬工業協会 DATA BOOK 2019 A7-9 開発段階別化合物数と承認取得数(日本)
創薬と育薬(日本製薬工業協会HPより)
『成功率』引用元:日本製薬工業協会 DATA BOOK 2019 A7-9 開発段階別化合物数と承認取得数(日本)
創薬と育薬(日本製薬工業協会HPより)
治験のプロセス
治験は新しいくすりの安全性・有効性を確認するために必要不可欠な段階です。
臨床試験(治験:3~7年)
第Ⅰ相試験(PhaseⅠ)
- 健常人を対象
- 安全性/薬物動態
健康な成人に開発中の薬剤を投与し、薬剤が体にどのような影響を与えるかを確認します。
試験中は『その薬剤は人体に投与しても安全か』『体にどのように吸収され排泄されていくのか』『吸収・排せつにはどのくらいの時間がかかるか』などの内容を調べます。
第Ⅱ相試験(PhaseⅡ)
前期
- 患者対象(少数)
- 有効性/安全性(探索)
後期
- 患者対象
- 有効性/安全性
- 用量決定
比較的少数の患者さんに対して行われる試験です。
第Ⅰ相試験で安全が確認された用量の範囲で薬剤が投与され、投与の方法・回数・間隔などを調べます。
第Ⅲ相試験(PhaseⅢ)
- 患者対象(多数)
- 有効性/安全性(検証)
多数の患者さんに対して薬剤を投与し、実際の治療に近い形で薬の効果と安全性を確認します。この試験では、どこが異なっていて、どこが優れているかを調べるために、既存薬またはプラセボとの比較試験を行う場合があります。

